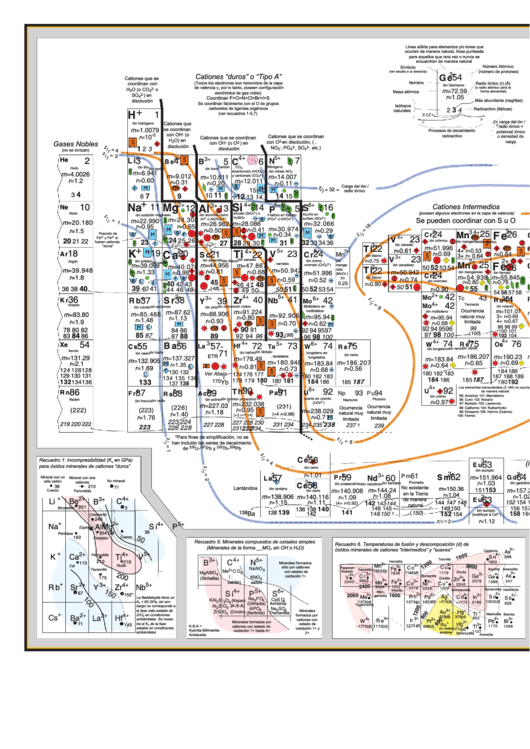
La Tabla Periodica De Los Elementos Y Sus Iones Para Ciencias De La Tierra
ADVERTISEMENT
F e
Línea sólida para elementos y/o iones que
Iones comúnmente enriquecidos en suelos residuales o sedimentos
Iones menos empobrecidos del manto en la formación de la corteza
Elementos que ocurren de manera nativa en la naturaleza,
Los 10 elementos más abundantes en la corteza terrestre
ocurren de manera natural, línea punteada
(símbolo pequeño indica menor certeza)
reconocidos antiguamente
para aquellos que rara vez o nunca se
Iones enriquecidos en CAIs (inclusiones ricas en Ca y Al en meteoritas)
Zr
11° al 20° elementos más abundantes en la corteza terrestre
encuentran de manera natural
Iones en nódulos ferromangánicos procedentes del fondo del
(
reconocidos a partir de la Edad Media hasta 1862,
con respecto a la composición del sistema solar
Símbolo
Número Atómico
océano, enriquecidos con respecto al agua de mar
L i
reconocidos después de 1963)
21° al 30° elementos más abundantes en la corteza terrestre
(número de protones)
Iones compatibles con primeras fases en cristalizar en rocas ígneas
(ver escala a la derecha)
3+
Cationes “duros” o “Tipo A”
G e 54
Cationes que forman minerales de fluoruros simples
Cationes que se
L u
31° al 40° elementos más abundantes en la corteza terrestre
Iones compatibles con últimas fases cristalinas en rocas ígneas
Elementos que forman aleaciones naturales minerales con Fe
coordinan con
(Todos los electrones son removidos de la capa
Nombre
Radio iónico (r) (Å)
Cationes que forman minerales de óxidos simples
debido a su gran tamaño (pincipalmente LILE)
Elementos considerados como principales constituyentes
ión Germanio
Elementos que forman aleaciones naturales minerales con Cu
de valencia y, por lo tanto, poseen configuración
H
O (o CO
2-
o
(o radio atómico para la
m=72.59
del núcleo de la Tierra (Fe>Ni>Co), posiblemente junto con
2
3
Masa atómica
forma elemental)
Cationes que forman minerales de sulfuros simples
electrónica de gas noble)
Los 8 solutos más abundantes en agua marina
Elementos que forman aleaciones naturales minerales con Os
SO
2-
) en
S y O
Gases Nobles
r=1.05
4
Coordinan F>O>N=Cl>Br>I>S
Cationes que forman minerales de bromuros o ioduros
disolución
Más abundante (negritas)
Elementos que forman aleaciones naturales minerales con Pt
9° a 16° solutos más abundantes
17° a 22° solutos más abundantes
(no se ionizan)
Se coordinan fácilmente con el O de grupos
simples
Isótopos
3
Elementos que forman aleaciones naturales minerales con Au
+
carboxilos de ligantes orgánicos
2
4
Radioactivo (itálicas)
-
H
naturales
Soluto más abundante en agua de río (HCO
)
Cationes que forman minerales con base en un oxianión
1
3
(ver recuadros 1-5,7)
He
2
E C,
+
(p.ej: S
6+
en sulfatos, A
5+
en arsenatos)
H
–
Los 4 constituyentes más abundantes de la atmósfera
1
2° a 8° solutos más abundantes en agua de río
-
z
= carga del ión /
Aniones
Helio
ión hidrógeno
Cationes que
r
Hidrógeno
radio iónico =
5° al 8° más abundantes
Iones que pueden ser limitantes para el crecimiento de bacterias
Aniones que forman minerales con K
+
y Na
+
m=1.0079
se coordinan
como hidruros
Procesos de decaimiento
Ver recuadro 8
m=4.0026
potencial iónico
-5
con OH
-
(o
Solutos que pueden ser nutrientes limitantes en los océanos
Aniones que forman minerales con Mg
2+
m=1.0079
r=10
Cationes que se coordinan
radioactivo
o densidad de
Cationes que se coordinan
r=1.2
H
O) en
Gases Nobles
2
con OH
(o O
) en
con O
2-
en disolución, (p.ej.,
carga
Solutos que son macronutrientes
Solutos que son micronutrientes
3+
4+
4+
r=2.08
-
2-
Aniones que forman minerales con Al
, Ti
y Zr
1
disolución
para plantas terrestres
para plantas terrestres
Aniones que comúnmente se coordinan con H
+
1
4
2 3
disolución
NO
-
, PO
3-
, SO
2- ,
etc.)
Gases
2 3
3
3
4
4
(no se ionizan)
Aniones que forman minerales con Si
4+
(p.ej: CH
, NH
, H
S, H
O, etc.)
4
3
2
2
+
Iones escenciales para la nutrición de algunos vertebrados (minerales escenciales)
6
8
–
4+
5+
7
He
2
L i
3
2+
4
3+
7
Aniones que forman minerales Cu
+
C
4–
6
N
3–
7
O
2–
F
9
10
B
5
C
6
N
8
B e
Ne
O
C
N
Aniones que forman minerales Ag
+
Helio
ión litio
Carbón p.ej., CO
,
Nitrógeno
2
ión carburo
ión nitruro
Oxígeno en óxidos
ión fluoruro
ión berilio
ión boro
2
Neón
- )
Carbono
2
m=4.0026
m=6.941
bicarbonato (HCO
p.ej., ión nitrato NO
-
No metales
m=12.011
m=14.007
3
3
m=15.999
m=9.012
y carbonato (CO
)
Aniones que forman minerales Au
+
(diamante
Nitrógeno
Oxígeno
m=18.998
m=10.811
2-
m=14.007
r=1.71
m=20.180
3
r=2.60
r=1.2
r=0.60
m=12.011
o grafito)
r=0.31
r=1.40
r=1.36
r=0.20
r=0.11
r=0.77
r=0.71
r=1.5
Carga del ión /
z
La mayoria de los carburos y nitruros naturales se
r=0.
15
= 32 =
r
radio iónico
z /
encuentran en meteoritas y fases minerales del manto
4
11
r = 16
16
19
3
7
9
10
12
14
17 18
6
13 14
15
12
14
20
21 22
13 14
15
+
Cationes que
Mg
S i
14
S i
4–
–
10
Na
11
2+
A l
3+
4+
5+
6+
13
16
3–
C l 17
18
Ne
12
13
14
5 1
S
16
Cationes Intermedios
14
P
15
2–
P
se coordinan con O
2-
, (± H
O) en disolución
S
16
A r
Elementos en forma nativa
2
16
A l
S i
S
(poseen algunos electrones en la capa de valencia)
S
4+
5+
33
6+
34
Neón
silicato (SiO
4 4-
) o
Azufre en
S e
ión sodio
ión magnesio
ión aluminio como
Fósforo en fosfato
A s
Elementos principales en
ión siliciuro
ión fosfuro
ión sulfuro
ión cloruro
azufre
(sin carga)
Argón
m=24.305
H
4
SiO
4
sulfato (SO
4 2-
)
Se pueden coordinar con S u O
m=22.990
Al
3+
o Al(OH)
3-n
(PO
4 3-
o HPO
4 2-
)
m=20.180
n
en sulfito (SO
2-
)
3-
selenato (SeO
2-
)
meteoritas ferrosas (Fe>>Ni>>Co)
m=26.982
m=28.086
m=32.066
3
arsenato (AsO
)
4
Aluminio
Silicio
Azufre
m=28.086
m=30.974
m=35.453
4
aparte de los gases nobles
m=32.066
r=0.95
r=0.65
r=0.37
y, junto con S y O, probablemente
m=39.948
m=30.974
r=1.43
r=2.71
r=0.50
r=0.41
r=0.47
r=0.42
r=2.12
r=1.81
r=1.5
r=0.29
3+
r=1.84
3+
24
Mn
3
4+
25
F e
26
3+
27
3+
4+
50
los elementos más abundantes en
r=1.34
Posición de
r=0.34
C r
,
C o
28
S n
r=1.8
Ni
2+
29
5+
51
52
C u
6+
el núcleo de la tierra
Fe
2+
y Fe
3+
si
V
4+
23
S b
T e
20
24
25 26
ión estánico
La mayoria de los silicuros y fosfuros naturales se
21 22
23
32
ión crómico
fueran cationes
27
28
29 30
31
33 34 36
ión manganeso
ión férrico
encuentran en meteoritas y fases minerales del manto
32
33 34 36
35
37
36 38
40
ión cobáltico
ión niquélico
ión cúprico
antimoniato
telurato
3+
ión vanadio
r=0.71
“duros”
F e
2+
F e
3+
T i 22
+
m=51.996
2+
3+
r=0.56
30
G a
31
r=0.62
24
26
27
28
29
30
33
34
2–
18
K
19
C a
2+
20
3+
T i
4+
5+
6+
r=0.61
4+ r=0.53
Zn
4+
32
34
–
35
36
21
22
V
23
24
7+
G e
3–
33
S e
K r
A r
S c
C r
Mn
r=0.69
r=0.64
r=0.63
A s
B r
3+ r= 0.64
r=0.73
r=0.69
3+
4+
34
ión titanio
3+
23
33
F e
C u
Zn
V
A s
S e
C r
C o
Ni
ión zinc
ión galio
ión germanio
A s
S e
ión escandio
ión vanadio
ión cromo p.ej.,
per-
r=0.75
2+
2+
2+
28
+
Kriptón
Argón
ión potasio
ión titanio
Mn 25
F e
2+
C u
29
ión arseniuro
ión selenuro
ión bromuro
ión calcio
C o
27
Ni
m=72.61
m=39.098
m=44.956
m=47.867
p.ej., vandato
cromato (CrO
2-
)
manga-
ión vanadoso
26
m=65.39
m=69.723
m=40.078
2+
50
52
53 54
arsenito
selenito (SeO
2-
)
Cromo
Hierro
Cobalto
Níquel
Cobre
Zinc
Arsénico
Selenio
m=83.80
4
T i 22
3
m=78.96
m=39.948
m=50.942
nato
ión niqueloso
r=0.53
r=1.33
r=0.81
r=0.68
ión cobaltoso
r=0.74
m=78.96
m=74.922
m=79.904
r= 0.99
m=51.996
m=50.942
ión manganoso
m=58.693
ión cuproso
r=0.62
r=1.26
r=1.9
(MnO
-
)
2+
24
ión ferroso
m=74.922
r=1.27
r=1.25
r=1.24
r=1.28
r=1.39
r=1.48
r=1.6
4
C r
m=58.933
r=1.8
m=54.938
m=55.845
m=63.546
(2+ r=0.93)
r=0.50
r=1.98
r=1.95
r=0.59
r=
ión titanio
r=0.74
r=0.72
r=2.22
r=0.52
(1+ r=1.13)
r=0.69
45
ión cromoso
r=0.74
64
66
40
r=0.80
r=0.76
r=0.96
70 72
74 76 77
(7+ r=0.39)
42 43
46 47
48
0.25
r=0.90
58 60
74 76 77
78 80 82
51
69
39
52
50
55
59
71
75
80
79
36 38
40
40 41
(48)
50
51
50
53 54
r=0.90
61 62 64
63
65
67 68 70
73 74 76
78
82
75
80
81
(82)
83
84
86
44 46 48
49 50
78
82
?
54 56 57 58
42
+
2+
49
4+
5+
53
2+
2+
2+
46
47
48
1
3+
2+
3+
51
52
I
–
54
36
+
2+
4+
40
5+
41
Mo
43
3
4+
44
45
A g
I n
,
Sn
50
Sb
T e
44
45
46
47
48
49
50
51
52
3–
2–
52
53
X e
R b
37
S r 38
3+
39
Zr
6+
42
T c
,
R h
P d
C d
51
T e
I
K r
Y
Nb
Mo
R u
S b
42
4+
ión indio
ión estanoso
ión antimonio
ión telurio
-
Kriptón
Mo
Tecnecio
ión paladio
ión cadmio
ión iodato (IO
)
R h
P d
I
n
ión ioduro
Xenón
ión estroncio
ión circonio
ión niobio
Molibdeno en
ión rutenio
ión rodio
ión plata
3
R u
A g
C d
S n
S b
T e
ión teluro
ión rubidio
ión ytrio
p.ej., antimonitas
p.ej., teluritas
Ocurrencia
m=114.818
m=126.904
ión antimoniuro
m=126.904
m=131.29
m=87.62
m=91.224
molibdatos
m=101.07
m=102.906
m=112.411
m=127.60
m=85.468
m=88.906
ión molibdeno
m=107.868
m=118.710
m=121.760
m=83.80
m=92.906
m=106.42
Rutenio
Rodio
Paladio
Plata
Cadmio
Indio
Estaño
Antimonio
Teluro
m=127.60
m=95.94
natural muy
r=0.44
r=2.16
r=2.1
r=1.13
r=0.80
m=95.94
3+ r=0.69
r=0.97
3+ r=0.81
r=0.89
r=0.86
r=1.26
r=0.90
r=1.48
r=0.93
r=0.86
r=1.12
m=121.760
r=2.21
r=1.9
limitada
4+ r=0.67
1+ r=1.32
r=1.34
r=1.34
r=1.37
r=1.44
r=1.56
r=1.66
r=1.58
r=1.61
r=1.7
(7+ r=0.50)
r=0.70
r=0.62
r=0.68
124 126 128
106 108 110
120 122 123
112 114 115 116
r=2.45
120 122 123
99
96 98 99
90
91
92 94 95 96
102 104 105
111 112 113
129 130 131
78 80 82
84 86
92 94 95 97
124 125 126
127
100 101
115
117 118 119
121
124 125 126
(124)
93
98
(100)
103
106
113
123
83
84
86
85
87
88
89
(96)
98
97
100
108 110
107
109
114
116
128 130
121
132
87
92 94 96
96
100
102 104
120
122 124
123
(128) (130)
134 136
?
128 130
+
4+
2+
+
80
81
3+
83
4+
74
4+
75
76
4+
77
78
+
79
T l
Pb
2+
82
B i
84
54
+
B a 56
2+
3+
57
4+
72
5+
73
6+
W
R e
O s
I r
Pt
A u
Hg
P o
73
75
76
77
78
79
80
81
82
83
2–
85
86
Xe
55
L a
-
Hf
74
7+
75
83
A t
R n
C s
T a
W
R e
B i
ión renio
ión osmio
ión bismutoso
ión tungsteno
ión iridio
ión platino
ión oro
ión mercuroso
ión teluroso
ión plomboso
Xenón
71
ión tántalo
Polonio
Ir
T l
P b
ión cesio
ión bario
ión hafnio
tungsteno en
m=204.383
m=208.980
T a
R e
Os
P t
A u
Hg
B i
Radón
ión renio
m=195.078
m=207.2
Astatino
ETR
p.ej., tantalatos
m=186.207
m=190.23
m=192.217
m=200.59
ión bismuturo
m=131.29
m=137.327
m=178.49
tungstatos
m=196.967
m=183.84
r=1.40
r=1.20
r=1.20
m=132.905
Tántalo
Renio
Osmio
Iridio
Platino
Oro
Mercurio
Talio
Plomo
Bismuto
m=180.948
m=183.84
m=186.207
r=0.65
r=0.69
r=0.96
(222)
r=2.1
r=0.66
r=1.37
r=1.19
r=1.35
r=0.64
m=208.980
r=0.81
r=1.69
r=0.73
r=0.56
r=1.46
r=1.37
r=1.35
r=1.35
r=1.38
r=1.44
r=1.60
r=1.71
r=1.75
r=1.82
124 126 128
r=0.68
210 211 212
184 186
190 192 193
?
(3+ r=0.85)
196 198 199
218 219
130 132
203
205
206
204 206 207
209
210 211
Ver Abajo
180 182 183
Los únicos bismuturos
129 130 131
174 176 177
195
200 201
214 215
215 218 219
220 222
180 182 183
187 188 189
191
193
194
208 210 211
134 135 136
212 214 215
minerales son de Pd,
180
181
184
186
185
187
197
207 208 210
132
133
170
178 179
180
184
186
187
192
196 198
202
204 206
216 218
134 136
Y b
185
190
212 214
Ag, Pt, Au y Pb
137 138
2+
80
3+
81
4+
82
5+
83
4+
90
4+
92
L
os elementos transuránidos (Z >94) no ocurren
Hg
T l
Pb
B i
86
+
T h
5+
6+
92
87
2+
88
3+
89
91
U
R n
F r
A c
P a
U
Np
93
P u
94
de manera natural
R a
ión mercúrico
ión telúrico
ión plúmbico
ión bismútico
ión uranio
95: Americio
101: Mendelevio
r=1.10
r=0.95
Radón
ión actinio
ión torio
ión protactinio
uranio en uranilo
Plutonio
r=0.84
r=0.74
ión francio
ión radio
Neptunio
r=0.97
96: Curio
102: Nobelio
?
m=232.038
(UO
2 2+
)
97: Berkelio
103: Lawrencio
La Tabla Periódica de los Elementos y sus Iones para Ciencias de la Tierra
m=227.03
(226)
(231)
Ocurrencia
Ocurrencia
98: Californio
104: Rutherfordio
(222)
(223)
r=0.95
m=238.029
Cationes “blandos” o “tipo B”
r=1.18
natural muy
natural muy
99: Einstenio
105: Hahnio (Dubnio)
r=1.40
(+4 r=0.98)
(+3 r=1.14)
r=1.76
r=0.7
100: Fermio
limitada
limitada
(Contienen uno o varios electrones en la capa de valencia)
L. Bruce Railsback, Department of Geology, University of Georgia, Athens, Georgia, 30602-2501 U.S.A. (rlsbk@gly.uga.edu).
223 224
227 228 230
*
Coordinan I>Br>S>Cl=N>O>F
219 220 222
227 228
231 234
234 235
238
237
?
239
223
226 228
232 *
231
234
Traducción por: Juan Pablo Bernal, Instituto de Geología, UNAM (jpbernal@geologia.unam.mx).
comúnmente se coordinan con el C de compuestos orgánicos
(p.ej: compuestos organomercurados)
*Para fines de simplificación, no se
Esta tabla fue originalmente publicada por la Geological Society of America en inglés en GEOLOGY, v. 31, p. 737-740, doi: 10.1130/G19542.1 (”An Earth Scientist’s Periodic Table of the Elements and Their Ions”
han incluido las series de decaimiento
por L. Bruce Railsback), con apoyo de la United States National Science Foundation, número de contrato 02-03115. La versión 4.7 de la tabla ha sido publicada por la Geological Society of America en inglés
de
235
U-
207
Pb y
232
Th-
208
Pb
dentro de la serie Maps & Charts, MCH092F, doi: 10.1130/2004AESPT, y puede adquirirse a través de la Geological Society of America.
Elementos de Tierras Raras (ETR)
4+
58
C e
Recuadro 1: Incompresibilidad (K
en GPa)
3+
(iones “duros” o “tipo A” en estado de oxidación 3+)
s
63
E u
para óxidos minerales de cationes “duros”
ión cerio
ión europio
Recuadro 3: Comportamiento de cationes “duros” a alta
Recuadro 4: Solubilidad de óxidos minerales de cationes “duros”
Recuadro 2: Dureza de óxidos minerales de cationes “duros”
Catión (delineado
3+
3+
3+
3+
3+
3+
r=1.01
3+
59
3+
61
62
64
3+
66
3+
68
70
3+
57
P r
Nd
60
P m
S m
m=151.964
G d
67
3+
Y b
71
temperatura
para cationes
Mineral con un
L a
65
Dy
E r
69
Mineral con dos
T b
Ho
T m
L u
intermedios)
sólo catión
No mineral
3+
r=1.03
ión yterbio
4+
cationes
C e
58
Prometio
ión samario
ión gadolinio
ión disprosio
+
2+
4+
5+
+
2+
4+
5+
ión praseodimio
ión neodimio
ión erbio
3+
+
T i
Li
B e
3+
C
N
38
210
ión terbio
ión lutecio
Li
B e
B
C
N
2+
3+
4+
5+
B
71
Lantánidos
No existente
ión holmio
ión tulio
m=173.04
Li
B e
B
C
N
T de fusión (K)
ión lantano
m=144.24
m=150.36
151
153
m=157.25
m=162.50
4.4
Cuarzo
ión cerio
m=140.908
Perovskita
m=167.26
9
2103
para óxidos de
Bromellita
–7.4
2.77
en la Tierra
r=0.94
Bromellita
r=1.08
r=1.04
m=158.925
m=174.967
1700
2681
723
216
m=138.906
m=140.116
r=1.09
2+
r=1.02
r=0.99
m=164.930
m=168.934
E n
cationes “duros”
+
63
r=0.96
2+
3+
4+
de manera
E u
(2+ r= 1.13)
Crisoberilo
Ab
Li
B e
B
C
r=0.93
r=1.15
r=1.11
142
144 147 148
152 154 155
r=1.00
156 158
r=0.97
(4+ r=0.92)
143 144
r=0.95
168 170 171
natural
8.5
Ab
F o
Los minerales se muestran con
162 164
166
175
2+
2+
Bromellita
251
3
140
146 145
149 150
156 157
160 161 162
176
176
Hf
+
2+
Mg
Al
3+
+
136 138
?
165
172 173
Mg
Al
3+
4+
5+
6+
círculos cuyo diámetro es
Mg
Al
3+
4+
5+
6+
ión europio
167 168 170
Na
S i
P
S
+
4+
5+
6+
Na
S i
P
S
138
138
139
141
(150)
158
159
169
Espinela
Na
S i
P
S
representativo de la proporción de
B a
142
148 150
152
154
160
163
164
174
176
?
Crisoberilo
?
(sustituye a Ca
2+
)
2345
9.9
3125
cada catión
–8.1
–3.9
–1.37
9
7
Q
Periclasa
–2.4
240
Periclasa
7.5-8
z/r = 2
r=1.12
5.5-6
1193
An
1996
855
290
+
Corindón
Cuarzo
Minerales de acuerdo a la
Corindón
Cuarzo
2+
3+
4+
5+
Na
Mg
Al
S i
P
2+
3+
temperatura típica de cristalización*:
Espinela
Fe
Fe
198
254
38
I
l
Periclasa
-----
K sp
-----
Cromita
160
Perovskita
Corindón
Cuarzo
+
+
3+
2+
4+
5+
6+
C r
Forsterita
2+
4+
5+
6+
Recuadro 5: Minerales compuestos de oxisales simples
K
C a
T i
V
C r
+
Di
An
3+
4+
5+
6+
K
C a
S c
T i
V
C r
K
Cr
T i
V
C r
Recuadro 6. Temperaturas de fusión y descomposición (d) de
Recuadro 7. Modelo conceptual sobre el comporta-
Recuadro 8. Solubilidad de haluros de cationes duros y suaves
2+
14.0
5.5
*
C a
Anortita
(Minerales de la forma __MO
sin OH o H
O)
>9
-----
–7.6
Cal
3.5
Rutilo
3-3.5
Cal
1.4
Rutilo
–9.7
n
2
óxidos minerales de cationes “intermedios” y “suaves”
5+
miento de los óxidos de cationes duros e intermedios
Augita
Casiterita
As
3+
2103
943
+
Shcherbinaíta
3200
S c
T i
Shcherbinaíta
2+
4+
5+
4+
Anión:
B i
K
C a
Perovskita
T i
V
Enstatita
S n
588
Villiaumita
F –
Sellaíta
3+
4+
5+
Tenorita
Mineral
Srilankita
6.5
Hornblenda
210
B
C
N
115
216
Minerales formados
Hematita
1903
(NaF)
AgF
3+
Li
N
Rutilo
Mn
3+
2+
No mineral
(MgF
)
Ilmenita
Cal
sólo por cationes
3+
C u
Minerales
NaNO
Paramon-
F e
C o
2
+
Tausonita
Argutita Arsenolita
1Å
2+
3+
4+
5+
6+
2+
3+
4+
5+
6+
Me
2+
C O
3
Eskolaíta
1353
(
d)
H
+
de un solo
S r
Y
Zr
Nb
Mo
+
4+
5+
6+
Magnetita
R b
S r
Y
Zr
Nb
Mo
MgAlB O
con estado de
troseíta
1168
d)
(
1719
Zincita
R b
S r
2+
3+
Zr
Nb
Mo
3
3+
1838
3+
4+
3+
C l –
Y
4
4+
C r
G a
As
catión
Apatito
4.3
(p.ej:
K N O
oxidación 1+
V
Bunsenita
2+
G e
Clorargyrita
6.5
175
(Sinhalita)
Cuprita
Zn
HgC l
3-4
28.9
3
2+
673
2938
3123
1785
1074
2603
2+
F e
2+
2+
2079
547
(AgCl)
2
(NaCl)
Halita
7
Titanita (esfena)
calcita)
salitre
2240
Mn
C o
C u
+
1388
Baddeleyita
Molibdita
Baddeleyita
Molibdita
+
2+
3+
4+
5+
Ni
2242
R b
S r
Y
Zr
Nb
Cuarzo
Circón
2054
1652
MgC l
2078
2228
1509
Dureza
4+
5+
6+
Romarchita Valentinita
2
S i
P
S
Wüstita
Monteponita
Biotita
87
Man-
B r –
Bromargyrita
Minerales
(Escala
152*
4+
2+
2+
2+
ganosita
Ag
+
2+
3+
S n
3+
z/r alto
HgB r
Feldespato-K
La Baddeleyita tiene un
Mo
R h
P d
C d
In
S b
(AgBr)
MgB r
NaB r
de dos
de Mohs)
Na
P
O
2
K Al
S
i
O
(Kspar)
C aS
O
2
3+
4+
5+
6+
2+
3+
4+
5+
6+
K
= 95 GPa, sin em-
3
4
4
(
d)
~473(d)
1353(d)
Enlaces catión-
cationes
La
Hf
T a
W
+
2+
4+
5+
6+
Albita
B a
La
Hf
T a
W
2
3
8
(Olimpita)
Anhidrita
1373(d)
1373(
d)
1023
>1773
2185
928
3+
s
2–
C s
B a
La
Hf
T a
W
bargo no corresponde a
Al
S O
i
(K-S-A)
Tugarinovita
O
5.5
R b
oxígeno muy
Cuarzo
2
5
AlP
O
Na
S
O
I –
Iodargyrita
6.7
la fase más estable de
4
2
4
3+
+
7
Mineral
ZrS O
i
(Circón)
Minerales
Au
Hg
MgI
NaI
2286
2580
3173
2058
1745
*El orden de cristalización en un
(Berlinita)
Thenardita
T l
+
z/r
intermedio
fuertes, repulsión
(AgI)
HgI
Perovskita
+
2+
3+
4+
ZrO
en condiciones
4
Masicolita
Bismita
z/r bajo
2
2
Tantita
C s
B a
La
Hf
2
formados por
magma depende de la presión, de las
423(d)
373(d)
ambientales. Se mues-
4+
4+
3+
2+
852
2+
3+
Enlace catión-
entre cationes
cationes con
W
R e
Ir
P t
Enlace catión-
composiciones del magma y del fluido
Minerales formados por
2+
P b
B i
10
-8
10
-6
10
-4
10
-2
1
100
–9.7
71
+
4+
4+
145
tra el K
de la fase
estado de
Au
Hg
3+
oxígeno
T h
4+
4+
Temperatura de fusión (K) de
T h
s
K-S-A =
cationes con estado de
~1773(d)
1173(d)
1273
(
d)
T l
1170
oxígeno débil
T h
598(d)
1098
Solubilidad de haluros de Ag
+
(
), Hg
2+2
(
),
estable en condiciones
oxidación 1+ y
sin óxidos
773(d)
* Una fase sintética de TiO
(no rutilo)
óxidos simples de cationes
Log de la actividad del catión
Kyanita-Sillimanita-
oxidación 1+ hasta 4+
fuerte
2
1107
ambientales
2+
estables
Montroydita
Na
+
( ), y Mg
2+
( ) en mol/L
es el óxido de mayor dureza conocido
Torianita
6
3493
en agua destilada a 25 °C
Andalusita
Avicenita
Ver también recuadro 6
“duros”
v. 4.7g01c
Suplemento electrónico 25-2-02: Bernal y Railsback, 2008, Revista Mexicana de Ciencias Geológicas, v. 25, núm. 2, p. 236-246
ADVERTISEMENT
0 votes
Related Articles
Related forms
Related Categories
Parent category: Education
 1
1








